Immobilized CALB
CALB immobilis est per adsorptionem physicam in resina hydrophobica valde quae est macroporosa, styrene/mehacrylata polymer.CALB Immobilizata applicationes in solvendo organicis et systematibus solvendo-liberis apta est, et REDIVIVUS et reddi potest multo tempore opportunis conditionibus.
Product Code: SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
Superior actio, selectivity chiralis altior ac stabilior.
- Melior effectus in gradibus non aqueis.
- Facile remove ab reactione ratio, reactiones celeriter terminare, et interdum residuum in re fuge.
potest REDIVIVUS et palimpsestus caedere sumptus.
| Actio | ≥10000PLU/g |
| PH range ad reactionem | 5-9 |
| Temperatus range pro reactione | 10-60℃ |
| Aspectus | CALB-IMMO100-A: Lumen luteum vel brunneum solidum CALB-IMMO100-B: Alba ad leve brunneis solidum |
| Magnitudo particula | 300-500μm |
| Damnum siccitate in 105℃ | 0.5%-3.0% |
| Resinae immobilization | Macroporus, styrene/ polymerus methacrilatus |
| Reactionem solvendo | Aqua, organica solvendo, etc., vel sine solvendo.Ad reactionem in quibusdam solventibus organicis, 3% aquae addi possunt ad effectum reactionem emendandam |
| Magnitudo particula | CALB-IMMO100-A: 200-800 μm CALB-IMMO100-B: 400-1200 μm |
Unitas definitio: 1 unitas respondet synthesi 1μmol per minuti propyl lauratam ab acido laurico et 1-propanol ad 60℃.Supra CALB-IMMP100-A et CALB-IMMO100-B respondent portantibus immobilibus diversis magnitudinibus particularibus.
1. Reactor generis
Enzyme immobilis applicatur utrique ollae batch reactor et tori fixi continuus reactor.Notandum est vitare contritionem propter vim externam in refectione vel impletione.
2. Reactio pH, temperatus et solvens
Enzyme immobilis ultimo addere debet, postquam aliae materiae additae et dissolutae sunt et pH adaequantur.
Si consumptio subiecti vel formatio producti mutationem pH per reactionem ducet, sufficiens quiddam addatur ad systema reactionis, vel pH per reactionem monitorem et componi debet.
Intra temperatura tolerantiae range CALB (infra 60℃), conversio rate aucta cum augmento caliditatis.In usu practico, reactionem temperatus secundum stabilitatem subiecti vel producti seligi debet.
Generaliter hydrolysis reactionem Esther apta est in systemate aqueo phase, dum synthesis est reactio congruens in systemate organico phase.Solvendo organica possunt esse ethanol, tetrahydrofuran, n-hexane, n-heptane et toluene, vel apta mixta solvendo.Ad reactionem in quibusdam solventibus organicis, 3% aquae addi potest ad effectum reactionis emendandum.
3. Reuse et servitium vitae CALB
Sub debita reactionis conditione, CALB repeti et reddi potest, et applicationes specificae temporibus diversis inceptis variant.
CALB si convaluisset, continue non restituitur et post recuperationem condi debet, lavari et siccari et signari debet 2-8, § .
Post plures gyros reuse, si efficientia reactionis leviter deminuta est, CALB apposite et uti continuari potest.Si efficientia reactionis serio minuitur, reponi debet.
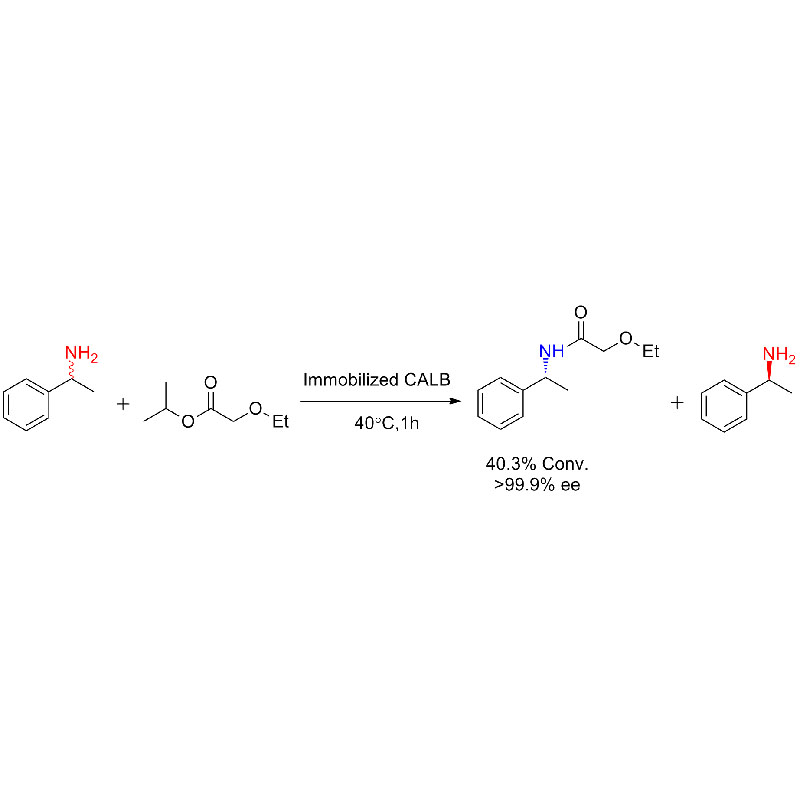
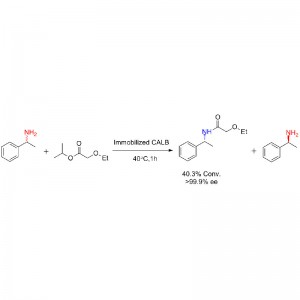
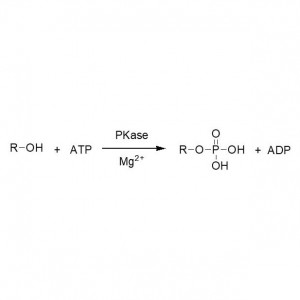
Exemplum 1(Aminolysis)(1):
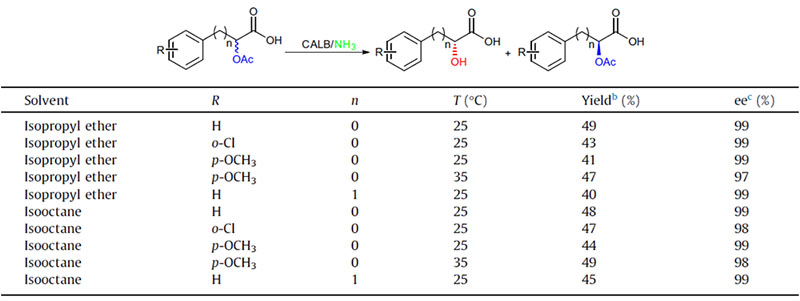
Exemplum 2(Aminolysis)(2):
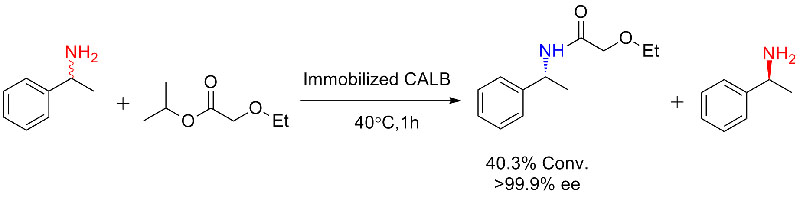
Exemplum III (Ring foramen polyester synthesis)(3):
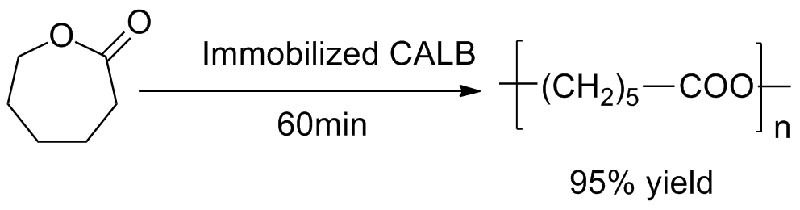
Exemplum 4 (Transesterification, regioselectivae globi hydroxyli)(4):
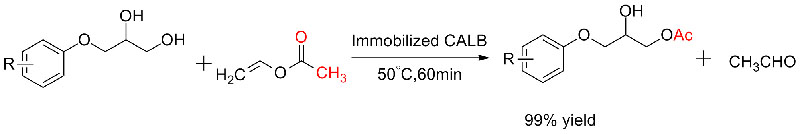
Exemplum 5 (Transesterification, motu resolutio racemicorum alcohols)(5):
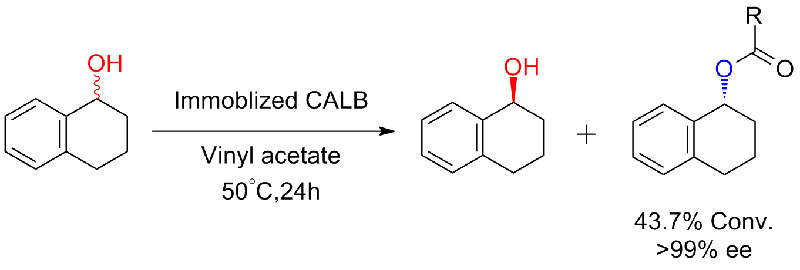
Exemplum 6 (Esterificatio, resolutio motuum acidi carboxylici)(6):
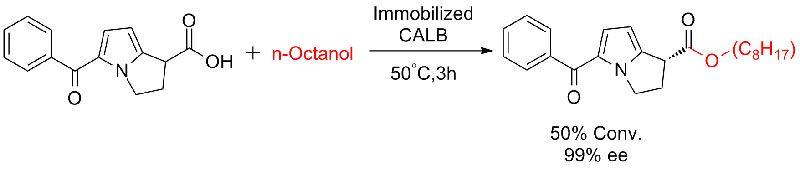
Exemplum 7(Esterolysis, in motu resolutio)(7):
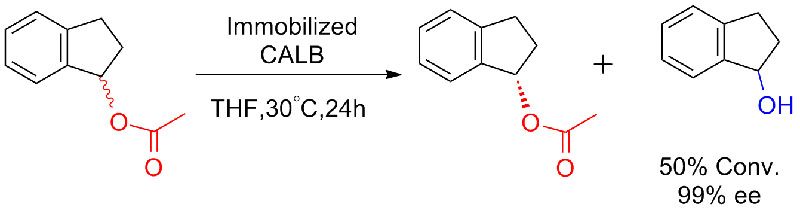
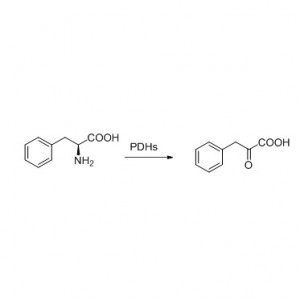
Exempli gratia 8 (Hydrolysis de amids)(8):
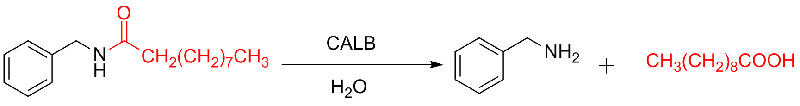
Exemplum 9 (Acylation of amin)(9):
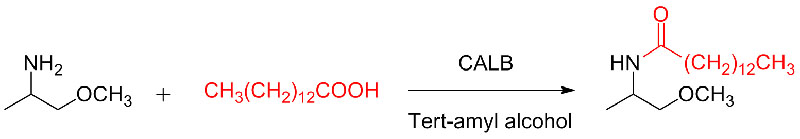

Exemplum 10 (Aza-Michael praeter reactionem)(10):
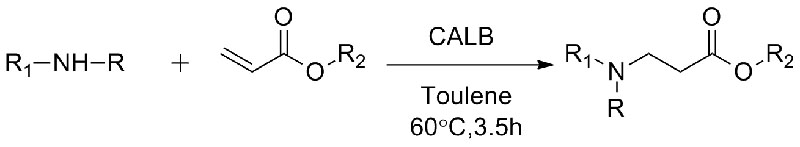
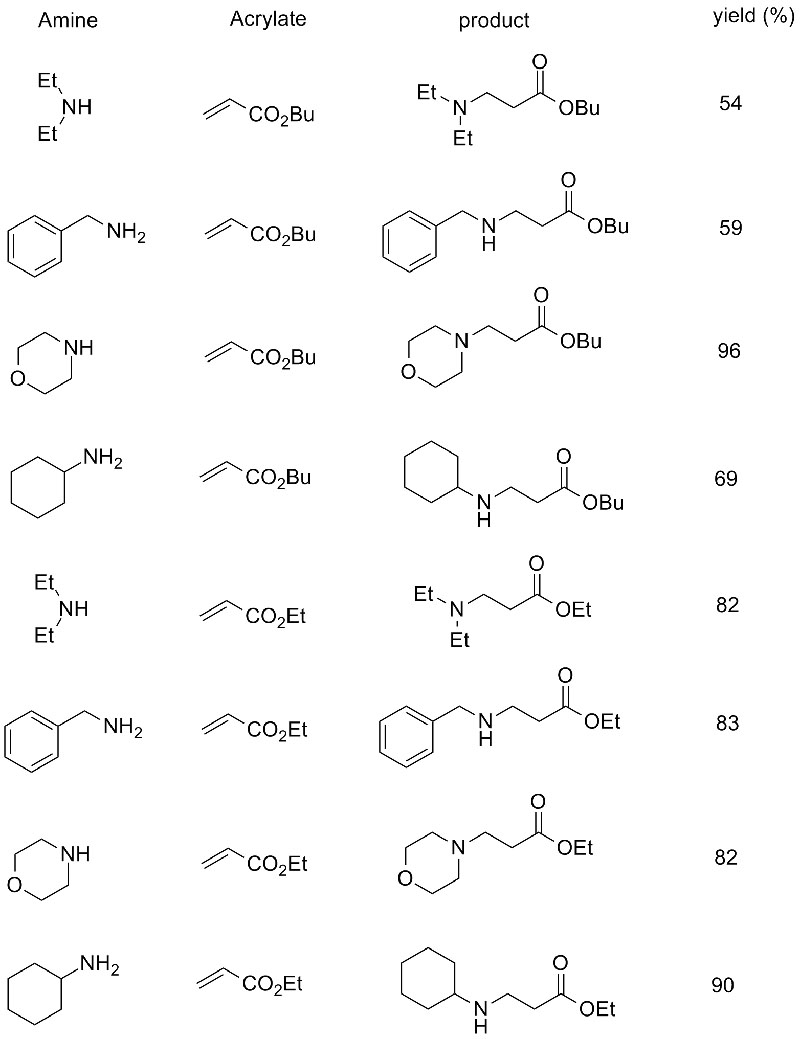
1. Chen S, Liu F, Zhang K, e tal.Tetraedron Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, e tal.Tetraedrum, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, e tal.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Catal.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA, e tal.J. Mol.Catal.B: Enzym, 2016, 130: 58-69.
8. Gavil´an AT, Castello E, L´opez-Mungu´AJ Mol.Catal.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, e tal.J. Mol.Catal.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, e ital.Tetraedron Lett, 2010, 51: 4455-4458.